Здравствуйте! Основными процессами, весьма важными и в теоретическом, и в прикладном отношениях, являются изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре, адиабатный — процесс, при котором отстутствует теплообмен с окружающей средой.
Анализ основных термодинамических процессов показывает, что теплоемкость остается постоянной в изохорном, изобарном, изотермическом и адиабатном процессах (без учета влияния температуры), что позволяет рассматривать эти процессы как частные случай политропного процесса. Особенностью каждого из этих процессов является различное соотношение между величиной работы dl и изменением внутренней энергии du.
Изохорный процесс.
В изохорном процессе п=±∞ и работа газа dl = 0. Количество теплоты, которой газ обменивается с окружающей средой, в соответствии с уравнением dq=du+dl равно изменению внутренней энергии: dq=du. Величину dq можно определить с помощью изохорной теплоемкости: dq = cυdT. Примером изохорного процесса является нагревание или охлаждение газа в закрытом сосуде при постоянном объеме.
Из уравнения Клапейрона pυ = RT следует, что в изохорном процессе (υ = const) изменение давления р прямо пропорционально изменению температуры Т (закон Шарля):
p/T = const.
Изобарный процесс.
Процессы изменения состояния при постоянном давлении (dp = 0) широко распространены в технологических и энергетических установках. Например, нагревание газа в теплообменных аппаратах обычно происходит по изобаре. В изобарном процессе с = cp и, как следует из выражения
n=0.
Для изобарного процесса из равенств dq = du + pdυ и R = pdυ/dT находим dq=du+RdT, следовательно, подведенная к газу теплота затрачивается на изменение внутренней энергии du и на работу против внешних сил RdT.
Определим количество теплоты, подведенной к газу в изобарном процессе. Дифференцируя выражение i= u+pυ, получим
di=du + pdυ + υdp. (1)
Для изобарного процесса dp = 0, и последнее уравнение принимает вид
di=du + pdυ. (2)
Сравнивая выражения dq = du + pdυ и (2), находим, что подведенное в изобарном процессе количество теплоты dq равно изменению энтальпии газа di.
Из уравнения Клапейрона pυ = RT при р = const может быть получено выражение υ/T = const, которое показывает, что при изобарном нагревании идеального газа удельный объем υ воз-растает пропорционально абсолютной температуре Т (закон Гей-Люссака).
Изотермический процесс.
После преобразования выражения
к виду
и подстановки значения теплоемкости изотермического процесса с = ∞ находим, что в изотермическом процессе n=1.
Следовательно, уравнением изотермы является выражение
pυ = const.
Из этого уравнения следует, что при подводе теплоты в изотермическом процессе объем газа должен увеличиться во столько же раз, во сколько раз уменьшилось давление (закон Бойля-Мариотта).
Согласно выражению du = cυdT, в изотермическом процессе du = 0 и и вся теплота затрачивается только на работу расширения:
dq = pdυ.
Адиабатный процесс.
Процесс называется адиабатным, если он совершается без теплообмена с окружающей средой (dq=0). Для осуществления адиабатного процесса на поверхность системы должна быть наложена идеальная тепловая изоляция. Опыт показывает, что к адиабатному процессу приближаются многие реальные процессы, протекающие с достаточно большой скоростью. При этом количество теплоты, которой система успевает обменяться с окружающей средой, невелико, и теплообмен практически не оказывает влияния на характер процесса. Поэтому с достаточной для практических расчетов точностью такие процессы можно рассматривать как адиабатные.
Уравнение адиабаты имеет вид
В адиабатном процессе с = 0 и, как следует из выражения
показатель адиабаты k равен
Так как теплоемкость в изобарном процессе ср больше изохорной теплоемкости cυ, то показатель адиабаты k>1.
Показатель адиабаты k зависит от атомности газа и температуры. Для двухатомных газов при t = 0°С k =1,4, а для трехатомных k= 1,33.
Показатель k зависит от температуры в меньшей степени, чем теплоемкости ср и сυ, так как обе теплоемкости изменяются с температурой в одном и том же направлении.
Из уравнений cp = cυ + R и (4) следует, что
Отсюда видно, что с увеличением температуры показатель адиабаты k уменьшается, причем гораздо медленнее, чем увеличивается теплоемкость сυ, поэтому для небольших интервалов изменения температуры в практических расчетах, не требующих высокой степени точности, показатель k можно принимать постоянным.
В адиабатном процессе (dq = 0) газ совершает работу за счет изменения внутренней энергии:
pdυ=—du.
Процессы изменения состояния идеального газа могут быть рассчитаны аналитически, однако при исследовании работы тепловых двигателей удобно также пользоваться графическим методом. Рассмотрим построение политропного процесса на диаграммах pυ и Ts. Из уравнения
политропного процесса следует, что политропа является кривой гиперболического типа, которая на рυ-диаграмме тем быстрее приближается к оси υ, чем больше показатель политропы.
На рυ-диаграмме (рис. 1) показаны частные случаи политропного процесса. Изохорному процессу соответствует вертикальная прямая 1—5, называемая изохорой. При изохорном процессе площадь диаграммы под кривой процесса, а следовательно, и работа в процессе равны нулю. Перемещение по изохоре вверх сопровождается увеличением температуры, т. е. подводом теплоты; при перемещении вниз теплота отводится.
Изобарный процесс изображается горизонтальной прямой 1—2. При перемещении по изобаре вправо происходит расширение газа и увеличение температуры, что возможно лишь при подведении теплоты к системе. Как следует из выражения (2) в изобарном процессе количество подводимой или отводимой теплоты равно изменению энтальпии, так как dp = 0.
Изотермический процесс представлен равносторонней гиперболой 1—3. Для того чтобы температура в процессе расширения 1—3 не изменялась, к газу необходимо подводить теплоту.
Адиабатный процесс изображается неравносторонней гиперболой
Так как для этого процесса k>1, то адиабата 1—4 проходит более круто, чем изотерма 1—3, для которой n=1.
В процессах расширения, расположенных выше изотермы 1-3 (0<n<1), проходит увеличение температуры и, следовательно, увеличение внутренней энергии и энтальпии газа за счет подведенной теплоты. В области между изотермой и изохорой при 1<n<∞ температура, внутренняя энергия и энтальпия газа при его расширении уменьшаются. При k<n<∞ работа совершается за счет уменьшения внутренней энергии. Между изотермой и адиабатой при 1<n< k газ производит работу за счет подведенной теплоты и изменения внутренней энергии.
Из рυ-диаграммы следует, что наибольшая величина работы расширения для изображенных процессов соответствует изобарному процессу 1—2 (n=0). С увеличением показателя политропы работа расширения уменьшается, и при п = ∞ она равна нулю (изохорный процесс 1—5).
На рис.2 рассмотренные процессы изображены в системе координат Ts. Изотермическому процессу соответствует горизонтальный отрезок 1—5, а адиабата представлена вертикальной прямой 1—2. Для анализа уравнения политропы с помощью Ts-диаграммы рассмотрим зависимость энтропии s от абсолютной температуры T. После подстановки в выражение ds=dq/T значения dq из соотношения dq = cdT найдем
Интегрируя в пределах от T1 до T2 при c = const, получим
Как следует из выражения (5), политропа в системе координат Ts изображается логарифмической кривой. Анализ уравнения (5) показывает, что при данном изменении энтропии ∆s отношение температур T2/T1 nем меньше, чем выше теплоемкость процесса. Поэтому с уменьшением теплоемкости процесса политропа будет проходить более круто, то есть будет больше отклоняться от горизонтали. Так как cp>cυ, то изобара 1—4 проходит на Ts-диаграмме выше, чем изохора 1—3. Исп. литература: 1) Теплотехника, под ред. А.П. Баскакова, Москва, Энергоиздат, 1982. 2)Теплотехника, Бондарев В.А., Процкий А.Е., Гринкевич Р.Н. Минск, изд. 2-е,"Вышейшая школа", 1976.


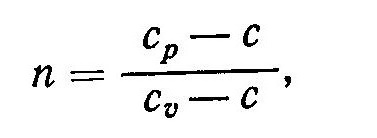
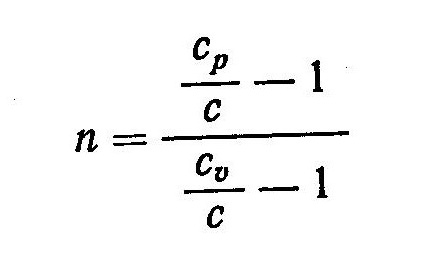
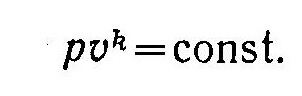
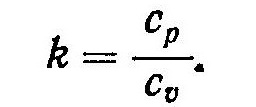
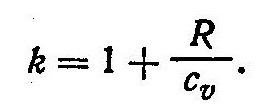
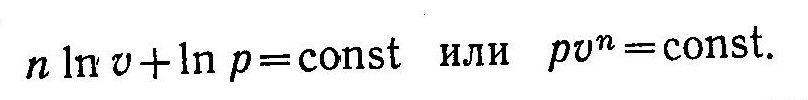

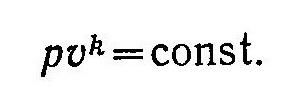
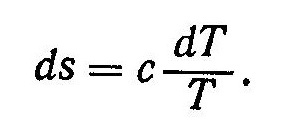
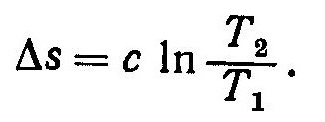
Добавить комментарий